LA BIOPSIA EMBRIONARIA (PGT), IN COSA CONSISTE?
Storia e prospettive future
La biopsia embrionaria è oggi largamente utilizzata per migliorare i risultati clinici in termini di impianto embrionario, gravidanza clinica e percentuale di nascite. Tale tecnica permette di individuare e quindi trasferire gli embrioni euploidi.
Il Test Genetico Preimpianto (PGT) fu introdotto per la prima volta nel 1993. Le prime biopsie portarono ad uno scarso incremento nell’aumento della percentuale delle nascite, questo perché lo screening genetico che veniva utilizzato (FISH) analizzava solo un ridotto numero di cromosomi. Lo sviluppo successivo di tecniche più sofisticate (a-CGH; NGS; rtq-PCR) portò ad un notevole vantaggio, ovvero permise l’analisi dell’intero pannello cromosomico, rendendo i risultati dell’analisi genetica più affidabili e completi.
Dal punto di vista prettamente tecnico la biopsia embrionaria consiste nel prelevare un piccolo campione di cellule dall’embrione (1° e/o 2° globulo polare, 1/2 blastomeri o 5/8 cellule del trofoectoderma) al fine di analizzarlo dal punto di vista genetico.
La biopsia dei globuli polari viene utilizzata nei Paesi con particolari restrizioni legali sulla valutazione genetica dell’embrione.
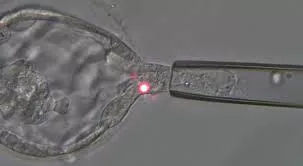
La biopsia dei blastomeri viene eseguita quando l’embrione ha raggiunto lo stadio di 6-8 cellule. Tramite l’uso del laser si crea un piccolo foro nella zona pellucida dell’embrione, si rimuovono 1 o 2 cellule (blastomeri)su cui si eseguirà l’analisi genetica.
Infine, la biopsia sulle cellule del trofoectoderma si esegue quando l’embrione ha raggiunto lo stadio di blastocisti espansa. La blastocisti è formata da due diversi tipi di cellule: le cellule della massa cellulare interna, che daranno origine ai tessuti fetali e il trofoectoderma, precursore della futura placenta.
Anche in questo caso si fora la zona pellucida della blastocisti con il laser e si preleva un piccolo gruppo di cellule (5/8) che rappresenta solo una minima quantità di tutto il trofoblasto. In questo caso la blastocisti dovrà essere crioconservata per un eventuale futuro trasferimento qualora risultasse euploide. Quest’ ultimo metodo è il più utilizzato in quanto è quello che dà una maggiore garanzia di risultato in termini di gravidanza clinica e percentuale di nascite.
Si è visto inoltre, che le blastocisti biopsiate in giorno 5 hanno una maggiore probabilità di essere euploidi rispetto a quelle che hanno raggiunto lo stadio idoneo alla biopsia in giorno 6 o 7.
Va comunque detto che un embrione euploide biopsiato in giorno 7, ha le stesse probabilità di esitare in una gravidanza di un embrione euploide fatto in giorno 5. Questo ci fa capire quanto sia importante eseguire la biopsia su tutte le blastocisti disponibili, indipendentemente dal loro timing di crescita.
Il Test Genetico Preimpianto è sicuramente una tecnica invasiva che deve essere eseguita da embriologi esperti, in quanto vi è una piccola probabilità di danno all’embrione.
A tale proposito si stanno studiando delle tecniche non invasive che diano informazioni sul genoma dell’embrione. Ad oggi esistono 2 alternative alla biopsia embrionaria, ovvero l’analisi del fluido presente all’interno della blastocisti e la ricerca del DNA embrionario nel terreno di coltura in cui è immersa la blastocisti.
Sebbene molto promettenti, queste tecniche, paragonate alla biopsia embrionaria, non danno ancora dei risultati attendibili al 100%, ne consegue che gli studi su queste procedure dovranno essere ulteriormente approfonditi.
Concludendo si può affermare che il test genetico preimpianto (PGT) è una valida tecnica per la valutazione degli embrioni euploidi prima di un transfer.
BLIOGRAFIA
Dahdouh E.M., Balayla J., García-Velasco J.A. Impact of blastocyst biopsy and comprehensive chromosome screening technology on preimplantation genetic screening: A systematic review of randomized controlled trials. Reprod. Biomed. Online. 2015;30:281–289. doi: 10.1016/j.rbmo.2014.11.015
Sahin L., Bozkurt M., Sahin H., Gürel A., Yumru A.E. Is preimplantation genetic diagnosis the ideal embryo selection method in aneuploidy screening? Kaohsiung J. Med. Sci. 2014;30:491–498. doi: 10.1016/j.kjms.2014.05.008.
Geraedts J., Collins J., Gianaroli L., Goossens V., Handyside A., Harper J., Montag M., Repping S., Schmutzler A.G. What next for preimplantation genetic screening? A polar body approach! Hum. Reprod. 2010;25:575–577. doi: 10.1093/humrep/dep446.
Minasi M.G., Colasante A., Riccio T., Ruberti A., Casciani V., Scarselli F., Spinella F., Fiorentino F., Varricchio M.T., Greco E. Correlation between aneuploidy, standard morphology evaluation and morphokinetic development in 1730 biopsied blastocysts: A consecutive case series study. Hum. Reprod. 2016;31:2245–2254. doi: 10.1093/humrep/dew183.
Rienzi L., Capalbo A., Stoppa M., Romano S., Maggiulli R., Albricci L., Scarica C., Farcomeni A., Vajta G., Ubaldi F.M. No evidence of association between blastocyst aneuploidy and morphokinetic assessment in a selected population of poor-prognosis patients: A longitudinal cohort study. Reprod. Biomed. Online. 2015;30:57–66. doi: 10.1016/j.rbmo.2014.09.012.
Hammond E.R., Cree L.M., Morbeck D.E. Should extended blastocyst culture include Day 7? Hum. Reprod. 2018;33:991–997. doi: 10.1093/humrep/dey091.
Hammond E.R., McGillivray B.C., Wicker S.M., Peek J.C., Shelling A.N., Stone P., Chamley L.W., Cree L.M. Characterizing nuclear and mitochondrial DNA in spent embryo culture media: Genetic contamination identified. Fertil. Steril. 2017;107:220–228. doi: 10.1016/j.fertnstert.2016.10.015.
Capalbo A., Romanelli V., Patassini C., Poli M., Girardi L., Giancani A., Stoppa M., Cimadomo D., Ubaldi F.M., Rienzi L. Diagnostic efficacy of blastocoel fluid and spent media as sources of DNA for preimplantation genetic testing in standard clinical conditions. Fertil. Steril. 2018;110:870–879. doi: 10.1016/j.fertnstert.2018.05.031
