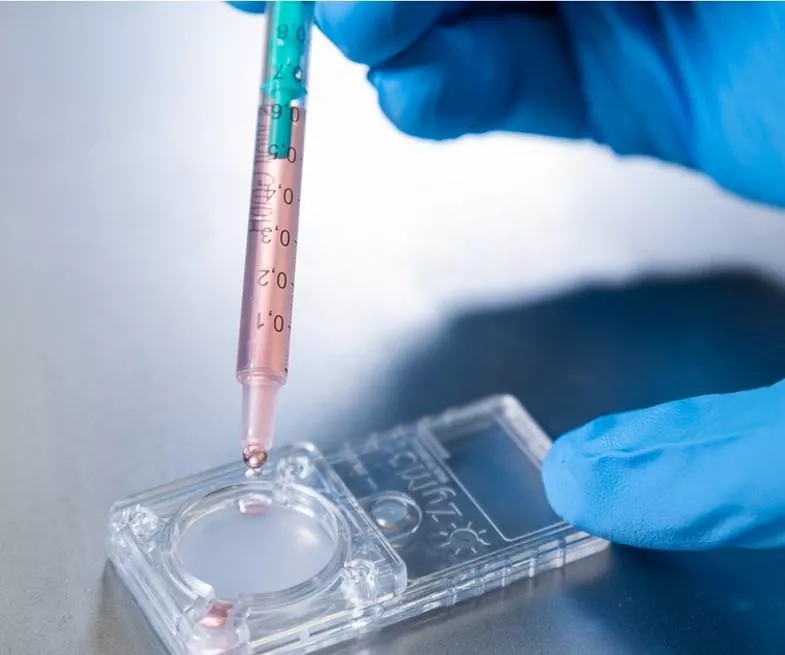
La selezione microfluidica degli spermatozoi
Oggi insieme al Dr. Roberto Sodano, embriologo clinico di CMR, vogliamo affrontare il tema della selezione microfluidica degli spermatozoi durante un ciclo di fecondazione in-vitro. Oggigiorno sono sempre di più le coppie che si rivolgono ad un centro di medicina della riproduzione aventi un deficit di qualità del liquido seminale. Basti pensare che il 5-10% degli uomini sposati ha o ha avuto problemi a riprodursi. Un recente studio ha dimostrato come la necessità per gli uomini di ricorrere ad un trattamento di fertilità sia in aumento del 9% negli ultimi dieci anni. Questo studio conferma, con un’analisi di un amplissimo campione, un trend già evidenziato da molti ricercatori in diversi lavori pubblicati nell’ultimo decennio. Nel 2011, un’analisi pubblicata sulla rivista “Human Reproduction Update” ha rilevato già una riduzione drastica del numero medio degli spermatozoi per ogni uomo sano, passando da 99 milioni per millilitro nel 1973 a 47 milioni. Non è chiaro cosa ha determinato questo peggioramento, ma le mutate abitudini e stili di vita (alcool, fumo, cattiva alimentazione, stress), l’inquinamento ambientale e dei luoghi di lavoro hanno avuto sicuramente un peso determinante. Durante un ciclo di fecondazione in vitro in laboratorio viene analizzato il liquido seminale. Successivamente alla valutazione dei parametri quantitativi e qualitativi, avviene una selezione degli spermatozoi da impiegare per l'inseminazione degli ovociti mediante separazione per gradienti di densità.In questa procedura avviene la rimozione del plasma seminale mediante lavaggio, la valutazione del numero di spermatozoi "migliori" dal punto di vista morfologico e di motilità, separandoli dagli spermatozoi morti e dai detriti. Negli ultimi anni è stata introdotta un'innovativa metodologia di selezione degli spermatozoi applicata durante un ciclo di fecondazione in vitro, ovvero la selezione microfluidica. Questo è un metodo selettivo degli spermatozoi che prevede l'utilizzo di un chip. Il metodo si basa sul principio della selezione naturale degli spermatozoi passando attraverso microcanali che simulano l’ambiente naturale del sistema riproduttivo femminile. Questi microcondotti funzionano come un filtro che seleziona solo spermatozoi di alta qualità. Con l'impiego della selezione microfluidica degli spermatozoi viene ridotto il rischio di ROS (Reactive Oxygen Species) e di danni al DNA dello spermatozoo, di conseguenza gli spermatozoi selezionati hanno una migliore morfologia, DNA non frammentato e più del doppio della vitalità e della motilità nei confronti degli spermatozoi non selezionati. Con la microfluidica però i liquidi seminali gravemente compromessi (criptozoospermici e campioni provenienti da biopsie e/o agoaspirazioni testicolari) non possono essere trattati. Infine l'impiego della selezione microfluidica permette agli operatori una maggiore rapidità di esecuzione della tecnica, aumenta il tasso di successo della gravidanza e riduce significativamente il numero di aborti durante la fecondazione in vitro. Riassumendo la microfluidica garantisce: massima imitazione del meccanismo naturale di selezione degli spermatozoi selezione di soli spermatozoi di alta qualità con il DNA non frammentato maggiore rapidità di esecuzione della tecnica riduzione significativa del rischio di aborto spontaneo nessuna centrifugazione con riduzione dello stress ossidativo degli spermatozoi. Viene indicata nei pazienti con: elevata frammentazione del DNA spermatico IUI ripetutamente fallite un tasso basso di fecondazione degli ovociti utilizzando il metodo ICSI aborti ripetuti embriotransfer ripetuto senza successivo annidamento dell'embrione qualità insufficiente degli embrioni BIBLIOGRAFIA: Total Motile Sperm Count Trend Over Time: Evaluation of Semen Analyses From 119,972 Men From Subfertile Couples. Ashley W Tiegs, Jessica Landis, Nicolás Garrido, Richard T Scott Jr, James M Hotaling Comparison of microfluid sperm sorting chip and density gradient methods for use in intrauterine insemination cycles. Gode, F., Bodur T., et al. Fertility and Sterility (2019). doi: 10.1016/j.fertnstert.2019.06.037 A treatment approach for couples with disrupted sperm DNA integrity and recurrent ART failure. Parrella, A., Keating, D., Cheung, S. et al. J Assist Reprod Genet (2019). doi: 10.1007/s10815- Selection of Functional Human Sperm with Higher DNA Integrity and Fewer Reactive Oxygen Species. Asghar, W., Velasco, V., Kingsley, J. L. et al. Adv. Healthcare Mater. (2014), 3: 1671-1679. doi: 10.1002/adhm.201400058

Le testimonianze del CMR: Natascia
Oggi vogliamo ringraziare Natascia per aver condiviso la sua esperienza e per aver riposto tutta la sua fiducia nel nostro operato. La mia storia inizia nel 2009 con la ruvida consapevolezza che a seguito di un intervento, non avrei mai potuto avere figli naturalmente, e la presa di coscienza di questa realtà in qualche modo mi ha allontanato dall'idea di poter diventare madre. Mi spaventava il percorso che avremmo dovuto intraprendere, non credevo di essere capace di affrontare tali insormontabili difficoltà. Con il passare degli anni nel 2020 ho iniziato a percepire che il "mio tempo" stava scorrendo velocemente e che la mia occasione di sentirmi chiamare "mamma" era diventata una possibilità sempre più sfumata e sempre più lontana. Mi sentivo smarrita, non sapevo a chi rivolgermi, in chi avrei potuto riporre tutta questa fiducia necessaria per intraprendere una sfida di questa portata. In seguito a svariate ricerche su internet ho letto di questo centro di medicina riproduttiva e procreazione assistita il CMR. Dalla prima volta in qui ci siamo recati presso questo centro siamo stati accolti e confortati, abbiamo trovato la risposta a tutte le nostre domande, esisteva la possibilità di avere un figlio. Il Dott. Maurizio Sodano ha sempre risposto a tutte le mie domande con sicurezza e fermezza senza tentennamenti o dubbi, mi ha sempre rassicurata sul percorso e sulle possibilità e anche quando si sono presentati degli ostacoli o delle sconfitte non mi ha mai abbandonata, il suo supporto é stato sempre presente fino alla nascita dei miei bambini. Ora posso dirlo siamo diventati genitori di due meravigliosi bambini, e ogni volta che mi abbracciano e mi chiamano mamma, il mio cuore esplode di gioia e un pensiero di immensa gratitudine e ringraziamento va sempre al Dott.Sodano e a tutta la sua equipe formidabile, senza di voi tutto questo non sarebbe mai stato possibile. Vi siamo eternamente debitori, ci avete regalato una vita piena, siete stati il mezzo attraverso il quale ho trovato, concepito, conosciuto e amato i miei bambini, sin dalle prime ecografie, é stato un viaggio mozzafiato. Il centro utilizza tecniche all'avanguardia, senza lista d'attesa, con garanzia di massima professionalità e trasparenza mi sento di poter dire che non potevo scegliere posto migliore alla quale affidarmi perché non si è mai persa l'umanità e l'empatia che un percorso del genere richiede, tutti danno davvero il meglio, i biologi, il Dott.Sodano, e la Dottoressa Casato, la segreteria. Un ringraziamento speciale va anche a Claudia che fa il suo lavoro con grande accoglienza e competenza senza far mai mancare un sorriso e una parola di conforto se la situazione lo richiede. Concludo volendo rassicurare chi ha dubbi su quale centro scegliere che il CMR é in assoluto il migliore sotto tutti i punti di vista, grazie di averci regalato un sogno tanto agognato e desiderato come i nostri figli. Natascia

Alimentazione e PMA
Seguire delle indicazioni nutrizionali, almeno 3 mesi prima dall’inizio della stimolazione ormonale, può essere un valido supporto alla coppia che decide di intraprendere un percorso di PMA. Questo perché sia il follicolo ovarico che lo spermatozoo impiegano circa 90 giorni per arrivare alla fase di maturazione e, questa è una finestra temporale ideale per migliorarne la qualità, aumentando le probabilità di un esito positivo. I miei consigli nutrizionali per tutte le coppie che intraprendono questo percorso sono: • Preferire alimenti biologici. • Preferire carne e latticini biologici o di allevamento all’aperto (senza l’utilizzo di ormoni). • Frutta e verdura di stagione e, preferibilmente, biologici. • Buona quota proteica in tutti i pasti della giornata. • Preferire alimenti integrali. • Adeguato apporto di verdure a pranzo e cena. • Consumare semi germogliati. • Aumentare alimenti con proprietà antiossidanti. • Consumare Crucifere per stimolare la via metabolica degli estrogeni. • Consumare cibi fermentati per la salute intestinale (un microbiota sano è fondamentale per la corretta metabolizzazione degli ormoni, per supportare il sistema immunitario e per ridurre i livelli di infiammazione sistemica). • Bere 2l di acqua al giorno. • Aumentare il consumo di alimenti ricchi di magnesio, acido folico, vitamina B12, vitamina C e omega-3. • Evitare alcol, caffeina e fumo. • Evitare dolcificanti artificiali, conservanti e additivi alimentari. Se non ci fosse il tempo di preparazione dei 3 mesi, si può comunque seguire dei consigli nutrizionali più mirati, per ogni fase del percorso di fecondazione assistita, da personalizzare alla coppia. Vediamone alcuni. Stimolazione ormonale La stimolazione ormonale potrebbe portare la donna a soffrire di ritenzione di liquidi. Ecco alcuni consigli per contrastarla: • Preferire una colazione salata • Ridurre il consumo di zuccheri semplici e carboidrati raffinati • Evitare lunghe cotture di verdure • Ridurre il consumo di passati e minestroni di verdure • Evitare il consumo di prodotti alimentari ricchi di sale • Preferire verdure amare e verdure a foglie verde Fase di prelievo degli ovociti In questa fase è importante garantire un corretto transito intestinale. Per questo si consiglia di bere 2 litri di acqua al giorno, consumare un apporto adeguato di fibra da frutta e verdura (ricordando che l’eccesso di fibra può causare occlusione intestinale!), condire la verdura con olio extra vergine di oliva, consumare passati di verdure e zuppe di legumi. In caso di stipsi può essere utile consumare 2-3 mele cotte al giorno o 2-3 prugne secche lasciate in ammollo tutta una notte. Fase di trasferimento degli embrioni Per favorire l’attecchimento degli embrioni, si consiglia di consumare alimenti che favoriscono un buon flusso sanguigno per apportare nutrienti all’utero: frutti di bosco, agrumi, anguria, melone, succo di melograno, ananas, kiwi e spezie come zenzero, origano e curcuma. Inoltre, per evitare contrazioni uterine, sarebbe meglio evitare tisane ed infusi di semi di finocchio, salvia, menta, camomilla, foglie di lampone. Bibliografia https://www.medscape.com/viewarticle/803821 https://www.fertstert.org/article/S0015-0282(12)00901-6/pdf https://pubmed.ncbi.nlm.nih.gov/17978119/

L'ovodonazione
Oggi nel nostro blog vogliamo illustrarvi l'ovodonazione, un trattamento di fecondazione eterologa medicalmente assistita, ne parliamo in questo articolo a cura della Dott.ssa Grazia Pettinau Ginecologa collaboratrice di C.M.R. L’ovodonazione Al giorno d’oggi sempre più coppie affrontano un percorso di fecondazione eterologa. Vediamo in cosa consiste e perché è così diffusa. La causa più frequente è sicuramente il fattore età: attualmente circa 35 donne su 100 ricercano una gravidanza dopo i 40 anni e, purtroppo, sappiamo che in questa fascia di età i tassi di successo con fecondazione omologa scendono drasticamente, sia per la quantità, che per la qualità degli ovociti residui a livello ovarico. Indubbiamente l’analisi genetica preimpianto (disponibile nelle altre sezioni del blog) nel contesto di un percorso di PMA, ci viene in aiuto nella selezione degli embrioni cromosomicamente euploidi ma, nonostante l’aiuto della tecnologia, non sempre riusciamo a soddisfare la volontà genitoriale delle coppie. Fra i trattamenti di fecondazione eterologa, vi è l’ovodonazione, che ci permette di superare il problema della qualità ovocitaria e di arrivare a una gravidanza nel 60-70% dei transfer, per aumentare quasi al 90% se si parla di tassi di gravidanza cumulativa (ossia sommando i vari transfer possibili nell’arco dello stesso ciclo). Dal punto di vista legislativo, con la sentenza 162/2014 è stata dichiarata l’illegittimità costituzionale del divieto di fecondazione eterologa medicalmente assistita e questo è stato il passaggio fondamentale per consentire alle coppie italiane di accedere a queste tecniche sul territorio italiano. Il percorso clinico prevede in primis un colloquio durante il quale si illustra in modo esaustivo il percorso e si procede alla discussione del consenso informato. Inizia quindi la fase diagnostica, che comprende tutti gli accertamenti preliminari maschili e femminili volti ad escludere eventuali problematiche seminali oppure eventuali patologie femminili che possano interferire con l’impianto e l’evoluzione embrionaria o che controindichino l’instaurarsi di una gravidanza; nell’ambito degli esami preliminari è anche possibile effettuare le indagini genetiche che consentono il matching con la donatrice (si tratta di un test che va a ricercare le malattie genetiche recessive più frequenti nella nostra area e, nel caso in cui si individui lo stato di ‘portatore’ di qualche malattia, si andrà a escludere la stessa nella donatrice). Si procede quindi al rilascio e al congelamento del campione di liquido seminale che viene poi inviato alla clinica partner che si occupa della fase operativa lato donatrice: la selezione della stessa viene operata in base alle caratteristiche fenotipiche della coppia e, se richiesto, si procede al matching genetico. Viene quindi effettuata la stimolazione ovarica della donatrice, il pick up e, a seguire, la generazione in laboratorio degli embrioni. Gli embrioni vengono quindi congelati e trasferiti nel nostro laboratorio dove verranno conservati fino al successivo transfer. A questo punto si procede alla preparazione endometriale della paziente, una procedura piuttosto semplice e poco impattante dal punto di vista fisico e terapeutico, in quanto la somministrazione di farmaci è davvero ridotta al minimo. Si procede quindi al transfer embrionario sotto guida ecografica, come illustrato nella sezione ‘fase operativa della PMA’. Nei giorni successivi si farà il test di gravidanza su sangue per verificare il successo del trattamento. Per ulteriori informazioni clicca sul link: https://www.infertilitadicoppia.com/fecondazione-eterologa.html

Le testimonianze del CMR: Francesca
Oggi a raccontarci la storia del proprio percorso presso il CMR è Francesca! Mi chiamo Francesca e con mio marito Marco avevamo già sentito parlare molto molto bene del CMR. Nel 2016 ci siamo recati presso il centro del dottor Sodano in quanto per quasi un anno abbiamo provato ad avere una gravidanza senza risultati, e la prima volta che abbiamo ottenuto un test positivo purtroppo ho avuto un aborto spontaneo. Sono stata splendidamente supportata e con un solo tentativo di inseminazione artificiale (IUI) sono rimasta incinta e ad Aprile 2017 è nata la nostra Giulia! Credevamo rimanesse figlia unica invece dopo pochi anni ci ha chiesto una sorellina o un fratellino! Purtroppo ho avuto un altro aborto spontaneo, risolto poi con una seconda splendida gravidanza aiutata da un'altra inseminazione artificiale andata a buon fine, al secondo tentativo. Ad Agosto del 2021 è nata la nostra seconda bimba, Gaia! Per tutte e due le volte ci siamo avvalsi del test genetico prenatale "Prenatal Safe" che si può fare presso il CMR e alle 12esima settimana eravamo al corrente del sesso edel fatto che godessero entrambe di buona salute. Ringraziamo e ringrazieremo sempre di cuore il dottor Sodano e tutto il suo staff per l'aiuto che ci hanno dato, perché grazie a loro abbiamo realizzato il nostro sogno più grande... essere genitori e avere una nostra famiglia! Tutti sempre super gentili, precisi e cordiali! Consigliamo a tutte le coppie in difficoltà, come lo siamo stati noi in passato, di rivolgersi presso questo meraviglioso centro!

Le testimonianze del CMR: Marco
Oggi a raccontarci la propria storia è un papà, Marco! La nostra piccola Sofia è arrivata grazie ad un percorso di PMA durato circa tre anni, un lungo periodo purtroppo caratterizzato da diversi tentativi falliti e momenti di puro sconforto, oggi per fortuna cancellati grazie a tutti i sorrisoni che ci regala ogni giorno la nostra bambina. Avevamo scoperto di avere problemi di concepimento quasi per caso (facendo degli accertamenti per altri motivi), ben prima di decidere di mettere su famiglia… Ma anche se avere un figlio non era in quel momento la nostra priorità, la diagnosi era stata ugualmente spiazzante: oligoazospermia severa. All’epoca essendo ancora giovani e, purtroppo, non essendo stati ben consigliati dai medici che ci seguivano in quel momento, non avevamo pensato a congelare il seme: avendo appena 26 anni, avrebbe potuto essere una buona idea in ottica futura… Infatti cinque anni dopo, quando finalmente ci siamo decisi a fare questo passo, la situazione era purtroppo peggiorata. Non conoscendo personalmente nessun centro di PMA, ci siamo affidati a un centro di Torino consigliatoci dalla ginecologa che ci seguiva. Purtroppo però il primo ciclo aveva dato origine solamente a due embrioni, risultati entrambi non trasferibili a causa di problemi genetici emersi grazie alla diagnosi preimpianto. Questa è stata la prima doccia fredda perché, sebbene fossimo pienamente consapevoli che non sarebbe stato facile, eravamo partiti ugualmente molto positivi. Abbiamo deciso di riprovare subito, questa volta con seme raccolto tramite TESE. Questo secondo ciclo ha dato origine a tre embrioni, due “sani” e il terzo non trasferibile secondo la diagnosi preimpianto. Purtroppo però entrambi i transfer non hanno portato ad una gravidanza… Questa è stata la seconda doccia fredda, perché eravamo assolutamente fiduciosi che almeno uno dei due embrioni avrebbe attecchito, senza contare il fatto che entrambe le volte la notizia dell’esito negativo ci è stata comunicata in modo sbrigativo e senza il minimo tentativo di approccio empatico. Il lungo stop dovuto al Covid ci ha dato l’occasione per riprendere il coraggio necessario per riprovarci e, soprattutto, per cercare un altro centro di PMA dove sentirci seguiti in modo più attento. È stato così che siamo arrivati al CMR. La differenza di approccio rispetto al centro precedente è stata subito evidente, vista la gentilezza di tutto lo staff e considerata la scrupolosità e chiarezza del Dottor Sodano durante le visite. Nonostante la situazione particolarmente “complicata” del seme, abbiamo deciso di riprovare ugualmente sebbene consapevoli, questa volta, che le possibilità di riuscita sarebbero state minime. Il primo ciclo ha dato origine a due embrioni, di cui uno ha portato ad una gravidanza biochimica. A questo punto, visti tutti i tentativi fatti, abbiamo deciso di cambiare rotta e ci siamo orientati verso la fecondazione eterologa (con donazione del seme), che ha dato finalmente i risultati sperati. Sul ricorso alla fecondazione eterologa, ci sentiamo di dire che, sebbene fossimo convinti fin dall’inizio che non sia necessario avere un legame di sangue per sentirsi genitori, un minimo timore di non sentire completamente “nostra” Sofia c’era…ma poi fin dalla prima ecografia ogni paura è svanita e adesso siamo completamente pazzi di lei! Questa è la nostra storia, il lungo viaggio che ci ha permesso di abbracciare la nostra bambina. Si dice che in un viaggio non sia importante la meta, ma il viaggio in sé…e se possiamo paragonare il percorso di PMA ad un viaggio, effettivamente conta tantissimo chi trovi a seguirti ed a consigliarti, con professionalità e gentilezza. Per questo ci sentiamo di consigliare il CMR a tutti coloro che, pur avendo difficoltà di concepimento, non vogliono rinunciare al sogno di avere un figlio.

Crioconservazione di gameti ed embrioni, in cosa consiste? Storia e prospettive future
In questo articolo a cura della Dr.ssa Francesca Messuti, embriologa del C.M.R., vogliamo addentrarci in uno dei campi più affascinanti della procreazione medicalmente assistita, ovvero la criopreservazione di gameti ed embrioni. La preservazione della fertilità è sempre stata oggetto di numerosi studi, infatti in passato diversi sono stati i tentativi di conservazione dei gameti, inizialmente soprattutto maschili, basti pensare che già nel 1776 Lazzaro Spallanzani tentò di criopreservare con la neve spermatozoi umani e nel 1886 Paolo Mantegazza pensò ad una Banca del Seme per conservare lo sperma dei soldati in partenza per la guerra utilizzando neve e ghiaccio. I primi successi arrivarono però con l'avvento dei crioprotettori e delle metodologie, messe in atto da Polge e Smith, che permisero di evitare la formazione di cristalli di ghiaccio intracellulari che avrebbero potuto distruggere le membrane cellulari causando la degenerazione dei gameti stessi. Il primo concepimento da spermatozoi eiaculati congelati in azoto liquido si ottenne nel 1953 con le metodologie messe in atto da J. Sherman. Un po’ più complicati furono i primi tentativi di criopreservazione dei gameti femminili (gli ovociti) e degli embrioni. Inizialmente si misero in atto diversi protocolli che facevano uso di diversi crioprotettori e del congelamento lento, il quale aveva una scarsa efficienza biologica e clinica. La prima gravidanza con l’utilizzo di ovociti congelati fu nel 1986, mentre la prima gravidanza ottenuta con embrioni congelati fu nel 1983. Da questo momento in poi fu un continuo susseguirsi di studi che puntavano al raggiungimento del protocollo ideale per congelare e scongelare ovociti ed embrioni che garantisse alta efficienza sia biologica che clinica. La vera svolta nel campo della criobiologia di gameti ed embrioni si ebbe con l’avvento della vitrificazione. La vitrificazione è una tecnica che porta il terreno di crioconservazione e le cellule in esso contenute ad uno stato di solidificazione simile al vetro. Per fare in modo che si giunga ad uno stato vitrificato si utilizzano alte concentrazioni di crioprotettori, si riduce al minimo il volume di terreno sul supporto che si utilizza per appoggiare il gamete o l’embrione (comunemente chiamato Paillette) e si massimizza la velocità di raffreddamento immergendo il campione direttamente in Azoto Liquido Criogenico (-23000°C/min). La vitrificazione rappresenta oggi la "tecnica elettiva" per quanto riguarda la crioconservazione di ovociti ed embrioni e ha sostituito (dal 2006 circa) la tecnica del congelamento lento, fornendo risultati estremamente alti in termini di sopravvivenza e ripresa di gameti e di embrioni vitrificati. Basti pensare che al CMR, si ha un tasso di sopravvivenza allo scongelamento degli embrioni crioconservati del 98%. Si tratta infatti di una metodologia ampiamente studiata e sicura, in quanto a temperature criogeniche, ovvero al di sotto dei -180°C, si ha la sospensione di tutti i fenomeni biochimici e fisici cellulari. Si stima inoltre che la vita media del materiale biologico correttamente stoccato in azoto liquido (-196,5° C) sia all'incirca di 1000 anni. L’avvento di questa metodologia ha fornito nel campo della procreazione medicalmente assistita uno strumento fondamentale in quanto permette di rendere sicure sia la preservazione della fertilità maschile che femminile, sia la crioconservazione di embrioni. La crioconservazione viene eseguita oltre che su gli embrioni sovrannumerari anche su quelli sottoposti a biopsia del trofectoderma (PGT) e su quelli generati da trattamenti di fecondazione eterologa. Visto l’ampio utilizzo della vitrificazione, si stanno eseguendo nuovi studi e si pensa che il prossimo step nell’evoluzione della conservazione di gameti ed embrioni potrebbe essere, in un futuro non si sa ancora quanto vicino, la loro preservazione in uno stadio di disidratazione a temperatura ambiente. Per ulteriori informazioni e chiarimenti clicca sul link: https://www.infertilitadicoppia.com/trattamenti-procreazione-medicalmente-assistita.html Bibliografia: Cryopreservation of oocytes and embryos. A. Arav at al. Theriogenology. 2014 Jan 1;81(1):96-102. Cryopreservation of Gametes and Embryos and Their Molecular Changes. Enrique Estudillo at al. Int J Mol Sci.2021 Oct 8;22(19):10864 History of cryobiology, with special emphasis in evolution of mouse sperm cryopreservation. Jorge M Sztein 1, Toru Takeo 1, Naomi Nakagata 2 Cryobiology.2018 Jun;82:57-63.doi: 10.1016/j.cryobiol.2018.04.008 Cryopreservation A O Trounson at al. Br Med Bull. 1990 Jul;46(3):695-708 Human oocyte cryopreservation Debra A Gook at al. Hum Reprod Update. 2007 Nov-Dec;13(6):591-605. doi: 10.1093/humupd/dmm028. Epub 2007 Sep 10. Pregnancy after human oocyte cryopreservation C Chen at al. Lancet. 1986 Apr 19;1(8486):884-6. doi: 10.1016/s0140-6736(86)90989-x. Highly efficient vitrification method for cryopreservation of human oocytes. Masashige Kuwayama at al. Reprod Biomed Online. 2005 Sep;11(3):300-8.doi: 10.1016/s1472-6483(10)60837-1.

L'Endometriome, cos'è e in cosa consiste?
Oggi attraverso il nostro blog vogliamo focalizzare l'attenzione su un particolare test diagnostico conosciuto come Endometriome, ne parliamo in questo articolo a cura della Dott.ssa Claudia Casato Ginecologa di C.M.R. Endometriome è un test di screening che permette, mediante l'utilizzo di tecnologia NGS (Next Generation Sequencing), di riprodurre il profilo del microbiota endometriale a partire da una biopsia endometriale, eseguibile ambulatorialmente. L'endometrio, cioè la mucosa che riveste la superficie interna dell'utero e che deve accogliere l'embrione trasferito, infatti non è sterile ma è colonizzato da specie batteriche. In una situazione ideale la specie batterica prevalente è quella del Lattobacillus (>90%). Vi sono però situazioni in cui la flora batterica è alterata, per cui mediante questo test potremo riscontrare la presenza di: disbiosi, cioè una riduzione dei lattobacilli e concomitante aumento di altre specie batteriche non patogene; specie batteriche patogene e responsabili dell'endometrite cronica (Enterococcus spp., Enterobacteriaceae, Streptococcus, Staphylococcus, Mycoplasma, e Ureaplasma); specie batteriche patogene sessualmente trasmissibili (Chlamydia e Neisseria). Il mancato equilibrio della flora batterica endouterina può comportare il fallimento dell'impianto embrionario o la gravidanza biochimica o l'aborto. Pertanto questo test è consigliabile alle coppie con ripetuti fallimenti di impianto o aborti precoci. Riequilibrare la colonizzazione batterica endometriale può favorire l'instaurarsi della gravidanza. Il test è semplice e non invasivo, la procedura è molto simile al prelievo per il Pap Test. Prevede un prelievo endometriale mediante l'utilizzo di una cannula sottile, della durata di 5 minuti, che si esegue ambulatorialmente tra il 15° ed il 25° giorno di mestruazione. Il risultato è disponibile in circa 15 giorni. In base all'esito del test verrà prescritta la terapia da seguire. Un test positivo per disbiosi prevederà una cura correttiva con probiotici per via orale e vaginale, mentre un test positivo per endometrite cronica o malattie sessualmente trasmissibili prevederà una cura antibiotica oltre che probiotica. Per ulteriori informazioni e chiarimenti clicca sul link: https://www.infertilitadicoppia.com/endometriome-screening-test.html BIBLIOGRAFIA Evidence that the endometrial microbiota has an effect on implantation success or failure Moreno et al. Am J Obstet Gynecol 2016; 215:684-703. Endometrial microbiome at the time of embryo transfer: next-generation sequencing of the 16S ribosomal subunit - Franasiak et al. J Assist Reprod Genet 2016;33:129–136. Characterizing the endometrial microbiome by analyzing the ultra-low bacteria from embryo transfer catheter tips in IVF cycles: Next generation sequencing (NGS) analysis of the 16S ribosomal gene - Tao et al. Hum Microbiome J 2017;3:15–21. Prevalence of chronic endometritis in repeated unexplained implantation failure and the IVF success rate after antibiotic therapy - Cicinelli et al. Hum Reprod, 2015; 30(2):323-30 Chronic endometritis due to common bacteria is prevalent in women with recurrent miscarriage as confirmed by improved pregnancy outcome after antibiotic treatment - Cicinelli et al. Reprod Sci 2014; 21(5):640-7.